Seite 1 von 1
Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 14:29
von Lavidaloca07
Guten Tag,
ich habe eine Frage bezüglich der Zwangskarbonisierung und dem Coldcrash.
Ich hatte mein Jungbier zur Klärung auf 3 Grad für 48 Stunden gekühlt.
Anschließend habe ich das kalte Jungbier auf 4*10l Keg's verteilt. Danach habe ich die Fässer mit Co2 gefüllt. Der Spunddruck liegt bei 2,3 Bar. Ich bin dabei von der Lagertemperatur von 20 Grad ausgegangen und nicht von der aktuellen Würze Temperatur von 3 Grad.
Jetzt meine Frage , hat die Würze zu viel CO2 aufgenommen wie geplant, da ich mit der 20 Grad Lagertemperatur und nicht mit der 3 Grad Würze Temperatur.
Nach 72 Stunden habe ich deb Druck der Fässer gemessen, dieser liegt wie am Anfang bei 2,3 Grad. Das bier sollte auch die Lagertemperatur von 20 Grad angenommen haben.
Hätte eigentlich damit gerechnet das durch das erwärmen der Druck im Fass steigen müsste.
Hoffe ihr versteht was ich meine oder habe ich irgendwo ein Denkfehler.
Vielen Dank schon einmal im vorraus.
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 14:42
von MaltHopMagic
Mit 2,3bar bei 3 Grad bekommst du zu viel CO2 ins Bier. Das geht aber sehr langsam, bei still stehenden Fässern. Wenn sich dein Bier dabei erwärmt hat, dürfte noch keine überkarbonisierung eintreten sein.Ich vermute es nimmt immer noch Gas auf.
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 14:48
von OS-Schlingel
...im Zweifel kannst Du ja auch auf den berechneten Druck runtergehen....einfach entlüften...
Gruß Stephen
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 14:48
von Sebasstian
habe ich irgendwo ein Denkfehler.
Ja. Hier:
Lavidaloca07 hat geschrieben: Mittwoch 14. August 2024, 14:29
Der Spunddruck liegt bei 2,3 Bar. Ich bin dabei von der Lagertemperatur von 20 Grad ausgegangen und nicht von der aktuellen Würze Temperatur von 3 Grad.
Der Spunddruck ist von der aktuellen Temperatur abhängig. Kühlst du das Bier (und hoffentlich keine Würze) auf 3°C, dann sinkt der Spunddruck.
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 14:50
von §11
Dann stimmt etwas nicht. Was ich verstanden habe: Du hast dein Bier bei 3C mit 2,3bar karbonisiert und jetzt lagert es bei 20C.
Wenn dem so ist, dann hat dein Bier nun über 9g/l CO2 gebunden. Wenn es auf 20C erwärmt wird, sollte sich ein Druck von über 5 bar einstellen.
Sorry für die wagen Angaben, meine Tabelle enthält so hohe Werte nicht
Cheers
Jan
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 15:00
von Lavidaloca07
Ich habe die Fässer gerollt, gerüttelt bis kein CO2 mehr aufgenommen wurde. Habe mir dem Spundaperat jetzt noch mal nachgemessen. Der Druck liegt immer noch bei 2,3 Bar. Also keine Veränderung seit dem Beginn der Karboniesierung.
Es sind die 10l Keg's mit Typ A Flachkupplung. Sie sind schwarz isoliert. Die können ja keine 72 Stunden die Temperatur von 3 Grad halten.
Hätte wie gesagt auch mit einer Druckerhöhung gerechnet das Bier ja wieder ausgast bei höheren Temperaturen.
Was würdet Ihr denn jetzt machen, einfach abwarten

?
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 15:08
von PabloNop
Wie wurde der Druck gemessen? Eigenes Manometer oder am Druckregler?
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 15:11
von Lavidaloca07
Mit einem Spundaperat direkt am Keg.
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 15:18
von Lavidaloca07
Ich könnte theoretisch ja die Fässer noch mal öffnen mit einem Thermometer die aktuelle Temperatur messen und wieder mit CO2 befüllen?
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 15:20
von MaltHopMagic
Wenn du die Fässer gerollt hast, das wird dein CO2 Gehalt deutlich erhöht sein, wie Jan ausgerechnet hat. Du könntest mit einem Spundventil wieder ablassen, bei 20 Grad und 2,3bar Einstellung.
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 16:38
von Braufex
Wenn Du einen aussagekräftigen Druck zur Bestimmung der Karbonisierung bei der jetzigen Temperatur über die Tabelle bekommen möchtest, musst Du die Fässer vorher schütteln. Somit stellt sich ein CO2-Gleichgewicht zwischen der Flüssig- und der Gasphase ein und der Gasdruck über der Flüssigkeit entspricht der Karbonisierung laut Tabelle.
Das kannst Du Dir wie bei einer Mineralwasserflasche vorstellen. Wenn die geschüttelt wird, steigt der Druck bis zum Gleichgewicht.
Mit einem Flaschenmanometer könntest Du dann (in Verbindung mit der Temperatur) den Druck zur Bestimmung der Karbonisierung ablesen.
Bei einer Flasche, die schon länger ruhig steht, passt das nicht mehr.
Solltest Du beim Schütteln merken, dass der Druck im Fass stark ansteigt, solltest Du immer wieder etwas Druck ablassen, bis Du auf dem gewünschten Druck (passend zur Temperatur) landest.
Wenn alles passt, steigt der Druck im Fass nach dem Schütteln nicht mehr über 2,3 bar (bei 20°C und einer Karbonisierung von 5,4 g CO2/L)
Gruß Erwin
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 17:00
von baeckus
Lavidaloca07 hat geschrieben: Mittwoch 14. August 2024, 14:29
Guten Tag,
Ich bin dabei von der Lagertemperatur von 20 Grad ausgegangen und nicht von der aktuellen Würze Temperatur von 3 Grad.
Jetzt meine Frage , hat die Würze zu viel CO2 aufgenommen wie geplant, da ich mit der 20 Grad Lagertemperatur und nicht mit der 3 Grad Würze Temperatur.
Nach 72 Stunden habe ich deb Druck der Fässer gemessen, dieser liegt wie am Anfang bei 2,3 Grad. Das bier sollte auch die Lagertemperatur von 20 Grad angenommen haben
Hallo,
wieso willst du dein Bier bei dieser Temperatur lagern?
Ciao baeckus
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 17:16
von Lavidaloca07
Erstmal danke für eure Antworten und Ratschläge, werde es gleich mal wie Braufex machen.
Hab leider keinen großen Kühlschrank für 4* 10L Fässer.
Musste den Cold Crash in 2 Chargen machen.
Steht aber auf der Einkaufsliste, bin gerade erst angefangen mit dem Brauen

.
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 17:46
von MaltHopMagic
Braufex hat geschrieben: Mittwoch 14. August 2024, 16:38
Wenn Du einen aussagekräftigen Druck zur Bestimmung der Karbonisierung bei der jetzigen Temperatur über die Tabelle bekommen möchtest, musst Du die Fässer vorher schütteln. Somit stellt sich ein CO2-Gleichgewicht zwischen der Flüssig- und der Gasphase ein und der Gasdruck über der Flüssigkeit entspricht der Karbonisierung laut Tabelle.
Das kannst Du Dir wie bei einer Mineralwasserflasche vorstellen. Wenn die geschüttelt wird, steigt der Druck bis zum Gleichgewicht.
Mit einem Flaschenmanometer könntest Du dann (in Verbindung mit der Temperatur) den Druck zur Bestimmung der Karbonisierung ablesen.
Bei einer Flasche, die schon länger ruhig steht, passt das nicht mehr.
Solltest Du beim Schütteln merken, dass der Druck im Fass stark ansteigt, solltest Du immer wieder etwas Druck ablassen, bis Du auf dem gewünschten Druck (passend zur Temperatur) landest.
Wenn alles passt, steigt der Druck im Fass nach dem Schütteln nicht mehr über 2,3 bar (bei 20°C und einer Karbonisierung von 5,4 g CO2/L)
Gruß Erwin
Hallo Braufex, warum sollte eine lange still stehende Flasche (oder Faß) nicht im Gleichgewicht sein? Gleichgewichte stellen oft erst nach langer Zeit ein, weil das sich das System (geschlossene Flasche) dann ausgleichen kann. Zeit ist quasi die Voraussetzung für ein Gleichgewicht.
Gedankenexperiment:
Geschlossene, still stehende Flasche, 5,4g/L CO2 im Bier, 2,3 bar Druck im Kopfraum bei 20°C. Die Gesamtmenge des CO2 in der Flasche ändert sich nicht, solange sie geschlossen bleibt.
Das Schütteln der Flasche sorgt dafür, das das gelöste CO2 nach aussen drängt, zunächst in den Kopfraum, der Druck steigt. Dafür muss aber CO2 aus der Flüssigkeit austreten. Das Bier hat jetzt weniger als 5,4 g/L gelöst, das CO2 ist in den Kopfraum entwichen, der Druck dort liegt höher als 2,3bar.
Wenn das System jetzt kurz geöffnet wird, bis zur Reduktion des Kopfraumdruckes auf 2,3bar, entweicht CO2 aus dem System. Diese CO2 ist verloren, das Bier in der Flasche hat weniger als 5,4g/L CO2.
Ende.
Nun ist genau genommen auch die geschüttelte Flasche auch in einem Gleichgewicht, aber eben im bewegten System. Der Druck wird bis auf einen Wert X ansteigen, der sich auch durch längeres Schütteln nicht ändert, also ausgeglichen.
Ein geschütteltes und ein bewegtes System sind nicht das Gleiche. Ein warmes und ein kaltes System auch nicht. Das sind alles Rahmenbedingungen, die sich auf das System und damit auf die Gleichgewichtsbedingungen auswirken.
Heißt: Man kann das überschüssige CO2 schon rausschütteln, aber anhand des Druckes nicht sofort ablesen, ob man den Zielgehalt von 5,4g/L erreicht hat.
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 18:35
von §11
MaltHopMagic hat geschrieben: Mittwoch 14. August 2024, 17:46
Braufex hat geschrieben: Mittwoch 14. August 2024, 16:38
Wenn Du einen aussagekräftigen Druck zur Bestimmung der Karbonisierung bei der jetzigen Temperatur über die Tabelle bekommen möchtest, musst Du die Fässer vorher schütteln. Somit stellt sich ein CO2-Gleichgewicht zwischen der Flüssig- und der Gasphase ein und der Gasdruck über der Flüssigkeit entspricht der Karbonisierung laut Tabelle.
Das kannst Du Dir wie bei einer Mineralwasserflasche vorstellen. Wenn die geschüttelt wird, steigt der Druck bis zum Gleichgewicht.
Mit einem Flaschenmanometer könntest Du dann (in Verbindung mit der Temperatur) den Druck zur Bestimmung der Karbonisierung ablesen.
Bei einer Flasche, die schon länger ruhig steht, passt das nicht mehr.
Solltest Du beim Schütteln merken, dass der Druck im Fass stark ansteigt, solltest Du immer wieder etwas Druck ablassen, bis Du auf dem gewünschten Druck (passend zur Temperatur) landest.
Wenn alles passt, steigt der Druck im Fass nach dem Schütteln nicht mehr über 2,3 bar (bei 20°C und einer Karbonisierung von 5,4 g CO2/L)
Gruß Erwin
Hallo Braufex, warum sollte eine lange still stehende Flasche (oder Faß) nicht im Gleichgewicht sein? Gleichgewichte stellen oft erst nach langer Zeit ein, weil das sich das System (geschlossene Flasche) dann ausgleichen kann. Zeit ist quasi die Voraussetzung für ein Gleichgewicht.
Gedankenexperiment:
Geschlossene, still stehende Flasche, 5,4g/L CO2 im Bier, 2,3 bar Druck im Kopfraum bei 20°C. Die Gesamtmenge des CO2 in der Flasche ändert sich nicht, solange sie geschlossen bleibt.
Das Schütteln der Flasche sorgt dafür, das das gelöste CO2 nach aussen drängt, zunächst in den Kopfraum, der Druck steigt. Dafür muss aber CO2 aus der Flüssigkeit austreten. Das Bier hat jetzt weniger als 5,4 g/L gelöst, das CO2 ist in den Kopfraum entwichen, der Druck dort liegt höher als 2,3bar.
Wenn das System jetzt kurz geöffnet wird, bis zur Reduktion des Kopfraumdruckes auf 2,3bar, entweicht CO2 aus dem System. Diese CO2 ist verloren, das Bier in der Flasche hat weniger als 5,4g/L CO2.
Ende.
Nun ist genau genommen auch die geschüttelte Flasche auch in einem Gleichgewicht, aber eben im bewegten System. Der Druck wird bis auf einen Wert X ansteigen, der sich auch durch längeres Schütteln nicht ändert, also ausgeglichen.
Ein geschütteltes und ein bewegtes System sind nicht das Gleiche. Ein warmes und ein kaltes System auch nicht. Das sind alles Rahmenbedingungen, die sich auf das System und damit auf die Gleichgewichtsbedingungen auswirken.
Heißt: Man kann das überschüssige CO2 schon rausschütteln, aber anhand des Druckes nicht sofort ablesen, ob man den Zielgehalt von 5,4g/L erreicht hat.
Die manometrishen Methoden beruhen auf dem Henry-Dalton‘schen Gesetz, wonach bei gegebener Temperatur die Konzentration des in einer Flüssigkeit gelösten idealen Gases dem Partialdruck des Gases in der Gasphase proportional ist, sofern ein Gleichgewichtszustand besteht. Dieser Gleichgewichtszustand wird durch kräftiges Schütteln des karbonisierten Getränks erreicht. Zur Messung des Gesamtdrucks dient ein Manometer.
Quelle:
https://www.mebak.org/methode/b-420-26- ... trisch/739
Cheers
Jan
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 19:30
von Lavidaloca07
Ich habe es jetzt wie Braufex gemacht, durch das Schütteln entstand ein Druck von ca. 3,2 Bar. Habe dann Co2 auf 2,3 Bar abgelassen. Kontrolliere es in einer Woche noch einmal und lasse dann eventuell noch Druck ab bzw fülle auf..
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 19:34
von Braufex
§11 hat geschrieben: Mittwoch 14. August 2024, 18:35
Die manometrishen Methoden beruhen auf dem Henry-Dalton‘schen Gesetz, wonach bei gegebener Temperatur die Konzentration des in einer Flüssigkeit gelösten idealen Gases dem Partialdruck des Gases in der Gasphase proportional ist, sofern ein Gleichgewichtszustand besteht. Dieser Gleichgewichtszustand wird durch kräftiges Schütteln des karbonisierten Getränks erreicht. Zur Messung des Gesamtdrucks dient ein Manometer.
Quelle:
https://www.mebak.org/methode/b-420-26- ... trisch/739
Cheers
Jan
Danke Jan,
nicht zu vergessen der nächste Absatz Deiner Quelle.
Bei abgefüllten karbonisierten Getränken ist jedoch neben dem Kohlendioxid immer eine gewisse Menge Luft im Flaschenhals vorhanden, wodurch der Partialdruck des Kohlendioxids verändert wird. Der „Luftgehalt“ Getränks wird bei der Gesamtdruckmessung miterfasst, d. h. die Messwerte sind, bedingt durch das Messprinzip, immer zu hoch. Für präzise Messungen des CO2-Gehalts ist der Partialdruck der Fremdgase (z. B. O2, N2) zu berücksichtigen.
Jack Frost hat da mal einen ermittelten Wert von zusätzlich ca. 0,8 bar für Luft (O2/N2) bei seiner Flaschengärung angegeben.
Ist natürlich wieder abhängig vom Anteil der Luft im Kopfraum der Flaschen.
Gruß Erwin
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 19:58
von Braufex
Lavidaloca07 hat geschrieben: Mittwoch 14. August 2024, 19:30
Ich habe es jetzt wie Braufex gemacht, durch das Schütteln entstand ein Druck von ca. 3,2 Bar. Habe dann Co2 auf 2,3 Bar abgelassen. Kontrolliere es in einer Woche noch einmal und lasse dann eventuell noch Druck ab bzw fülle auf..

3,2 bar geschüttelt (nicht gerührt

) entsprechen dann 6,9g CO2/L.
Wenn keine Luft eingeschlossen war ...
Durch das Entlüften hast Du diesen Anteil auf jeden Fall reduziert

Gruß Erwin
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Mittwoch 14. August 2024, 21:42
von MaltHopMagic
Die Haffmanns Formel zeigt:
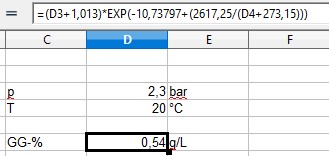
- Screenshot 2024-08-14 211902.jpg (15.46 KiB) 2285 mal betrachtet
Das würde für das geschüttelte Bier gelten.
Was sollte ich denn, am Beispiel einer Flaschengärung beobachten?
Variante 1:
Zucker rein, Manometer drauf, gären lassen, der Druck steigt bis auf 2,3bar? Wenn ich dann schüttle, dürfte der Druck nicht weiter steigen, sonst passt das nicht zum beschriebenen Messprinzip (Messen nach schütteln)!
ODER
Variante 2:
Zucker rein, Manometer drauf, gären lassen, der Druck steigt bis auf weniger als 2,3bar. Wenn ich dann schüttle, steigt der Druck auf 2,3bar? Kann ich mir auch nicht vorstellen. Das widerspricht meiner Vorstellung der Abläufe bei der
Zwangskarbonisierung. Still stehendes Bier unter 2,3bar CO2 Druck bei 20°C erreicht nach laaaanger Zeit einen CO2 Gehalt von 0,54g/L!
Ist die Annahme überhaupt richtig, das in einer geschlossenen Flasche der Druck ansteigt, wenn man schüttelt?
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Donnerstag 15. August 2024, 08:24
von Lavidaloca07
Bei meiner Flaschengärung ist eine Prüflasche zum Glück auf dem Teppich gefallen, der Druck ist dann von 2,3 auf fast 4 Bar angestiegen. Das war kurz vor Ende der Nachgärung. Hab Sie dann eine Woche stehen lassen und der Druck hat sich wieder bei 2,3 Bar eingestellt. Durch den Fall wurde also CO2 vom bier abgegeben, allerdings wieder langsam aufgenommen.
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Donnerstag 15. August 2024, 10:28
von MaltHopMagic
Danke. Das deckt sich mit meinem Gedankenexperiment aus #14 und beantwortet die Schlussfrage aus #19.
Aber wie passt das zu dem verlinkten Test?
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Donnerstag 15. August 2024, 12:30
von Colindo
MaltHopMagic hat geschrieben: Mittwoch 14. August 2024, 21:42
Die Haffmanns Formel zeigt:
Ich kenne die Formel nicht, aber vom Cask Ale kenne ich die Faustregel, dass sich bei 13°C und 0 bar Druck (bzw. eben Atmosphäre) 2,2g/l CO2 lösen. Dass das bei etwas höherer Temperatur und deutlich mehr Druck so viel weniger sein soll, kann ich nicht glauben.
Eben nachgerechnet. Fabier kommt auf das Zehnfache:
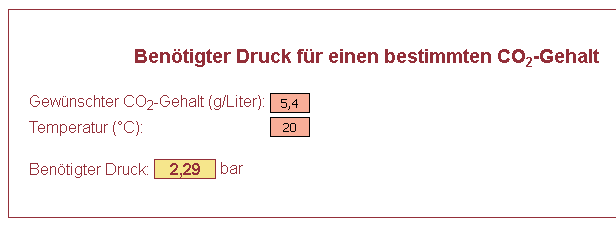
- Druck.png (5.01 KiB) 2157 mal betrachtet
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Donnerstag 15. August 2024, 14:26
von Ladeberger
Das Ergebnis der Haffmanns Formel stimmt schon, jedoch ist hier mit den Einheiten etwas durcheinander geraten. Der Wert 0,54 %GG beschreibt den Massenanteil in Verhältnidgröße Prozent, also g/100g. Für g/l (g/1000ml) ist das Ergebnis daher in die Verhältnisgröße Promille zu bringen (= verzehnfachen) und um die Dichte zu korrigieren, die sich hier jedoch nur auf die zweite Nachkommastelle auswirken dürfte. Für den Hausgebrauch passen 5,4 g/l daher schon.
Gruß
Andy
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Donnerstag 15. August 2024, 20:35
von MaltHopMagic
OK, Kommastellenfehler, habe ich übersehen. Es ging ja schon immer um 5,4g/L.
Was der Screenshot des Tabellenblattes zeigen sollte, wenn 2,3bar gemessen werden, sind 5,4g/L drin. Das gilt für eine ruhige Flasche.
Lavidaloca07 hat durch die heruntergefallene Flasche festgestellt, das in einer geschüttelten Flasche 4bar anliegen.
Was sich noch nicht erklärt hat, ist , warum für den Test geschüttelt werden muss. Vielleicht können braufex und $11 noch mal aufklären.
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Freitag 16. August 2024, 09:46
von Braufex
MaltHopMagic hat geschrieben: Donnerstag 15. August 2024, 20:35
Was sich noch nicht erklärt hat, ist , warum für den Test geschüttelt werden muss. Vielleicht können braufex und $11 noch mal aufklären.
Sorry, aber noch besser erklären als das von Jan verlinkte Zitat auf der sehr informativen Mebak-Seite kann ich das auch nicht ...
Die manometrischen Methoden beruhen auf dem Henry-Dalton‘schen Gesetz, wonach bei gegebener Temperatur die Konzentration des in einer Flüssigkeit gelösten idealen Gases dem Partialdruck des Gases in der Gasphase proportional ist, sofern ein Gleichgewichtszustand besteht. Dieser Gleichgewichtszustand wird durch kräftiges Schütteln des karbonisierten Getränks erreicht. Zur Messung des Gesamtdrucks dient ein Manometer.
https://www.mebak.org/methode/b-420-26- ... trisch/739
Gruß Erwin
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Freitag 16. August 2024, 12:26
von MaltHopMagic
Sorry, die Frage war nicht, wie die physikalischen Zusammenhänge sind, die sind in beiden Varianten gleich.
1. In in einer STILL stehenden Flasche werden 2,3 bar gemessen. Nach der im Link zu finden Formel errechnet sich ein CO2 Gehalt von 5,4g/L. Das deckt sich mit der Spundungstabelle
wiki/doku.php/spundungstabelle
2. Die gleiche Flasche (wie im verlinkten Verfahren und von dir beschrieben) geschüttelt zeigt einen höheren Druck. Daraus errechnet ein höherer CO2 Gehalt.
Mit Messung 1 und 2 ergibt sich ein offensichtlicher Widerspruch in den CO2 Gehalten der gleichen Flasche. Die Frage ist und war, woher der kommt.
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Freitag 16. August 2024, 15:11
von Braufex
Das Kohlenstoffdioxidgleichgewicht liegt im Ruhezustand bei hohem Druck auf der flüssigen Seite, das heißt, dass mehr Gas in der Flüssigkeit gelöst ist und somit weniger Teilchen in der Gasphase vorliegen; somit erniedrigt sich der Gasdruck in der Flasche.
Durch den Eintrag von Energie (Schütteln) wird das Gleichgewicht wieder hergestellt und der CO2-Anteil in der Gasphase steigt.
Dadurch auch der dann höhere Druck.
Anschließend weichen CO2-Moleküle dem Druck wieder aus indem sie sich in der Flüssigkeit wieder lösen, der Druck sinkt wieder.
Nur wenn ein Gleichgewicht besteht, ist der Druck (in Verbindung mit der Temperatur) für die Konzentration aussagekräftig.
Und dies besteht nur direkt nach dem Schütteln.
Wenn Du Dich da einlesen willst, such mal nach "Prinzip vom kleinsten Zwang" und "Prinzip von Le Chatelier".
Da kannst Du Dein Wissen vertiefen ...
Gruß Erwin
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Freitag 16. August 2024, 15:34
von §11
Braufex hat geschrieben: Freitag 16. August 2024, 15:11
Wenn Du Dich da einlesen willst, such mal nach "Prinzip vom kleinsten Zwang" und "Prinzip von Le Chatelier".
Da kannst Du Dein Wissen vertiefen ...
Gruß Erwin
Ist das Prinzip des Zwangs nicht von Donatien Alphonse François, Comte de Sade, bekannt als Marquis de Sade?

Cheers
Jan
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Freitag 16. August 2024, 15:42
von Braufex
§11 hat geschrieben: Freitag 16. August 2024, 15:34
Ist das Prinzip des Zwangs nicht von Donatien Alphonse François, Comte de Sade, bekannt als Marquis de Sade?

Cheers
Jan
Auch ein interessantes Thema.

Ob der da auch mit "
Zwangskarbonisierung" gearbeitet hat?

Gruß Erwin

Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Donnerstag 22. August 2024, 19:36
von MaltHopMagic
Braufex hat geschrieben: Freitag 16. August 2024, 15:11
Das Kohlenstoffdioxidgleichgewicht liegt im Ruhezustand bei hohem Druck auf der flüssigen Seite, das heißt, dass mehr Gas in der Flüssigkeit gelöst ist und somit weniger Teilchen in der Gasphase vorliegen; somit erniedrigt sich der Gasdruck in der Flasche.
Durch den Eintrag von Energie (Schütteln) wird das Gleichgewicht wieder hergestellt und der CO2-Anteil in der Gasphase steigt.
Dadurch auch der dann höhere Druck.
Anschließend weichen CO2-Moleküle dem Druck wieder aus indem sie sich in der Flüssigkeit wieder lösen, der Druck sinkt wieder.
Nur wenn ein Gleichgewicht besteht, ist der Druck (in Verbindung mit der Temperatur) für die Konzentration aussagekräftig.
Und dies besteht nur direkt nach dem Schütteln.
Wenn Du Dich da einlesen willst, such mal nach "Prinzip vom kleinsten Zwang" und "Prinzip von Le Chatelier".
Da kannst Du Dein Wissen vertiefen ...
Gruß Erwin
Hallo Braufex,
ich las, aber leider konnte ich mein Wissen nicht vertiefen, denn das war wieder ein Verweis auf die physikalischen Zusammenhänge die ich nicht in Frage stelle. Ich setzte die Unterhaltung nicht fort, denn das hat keinen Sinn, wenn wir keine Argumente diskutieren.
Grüße
Thomas
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Freitag 23. August 2024, 18:25
von Braufex
MaltHopMagic hat geschrieben: Donnerstag 22. August 2024, 19:36
Hallo Braufex,
ich las, aber leider konnte ich mein Wissen nicht vertiefen, denn das war wieder ein Verweis auf die physikalischen Zusammenhänge die ich nicht in Frage stelle. Ich setzte die Unterhaltung nicht fort, denn das hat keinen Sinn, wenn wir keine Argumente diskutieren.
Sorry, wenn ich Dich mit meinen Antworten nerv ...
Hab mir Mühe gegeben und Zeit genommen, Deine Frage richtig zu verstehen, mich selber nochmal einzulesen (ist bei mir lange her) und versucht eine detaillierte und sachliche Antwort darauf zu geben.
Leider hat mein Intellekt anscheinend dazu nicht ausgereicht.
Mit Messung 1 und 2 ergibt sich ein offensichtlicher Widerspruch in den CO2 Gehalten der gleichen Flasche. Die Frage ist und war, woher der kommt.
Vielleicht ist die Kurzform besser: Weil die Messung 1 (2,3 bar ohne Schütteln) nicht repräsentativ ist ...
Im Gegensatz zu Messung 2.
Die Bemerkung, dass Du mit dem Link Dein Wissen vertiefen kannst, war weder ironisch noch zynisch gemeint. sondern sollte eine echte Information für Dich sein, um es selber nochmal nachzulesen.
Für einen einen kleinen Teil der Hobbybrauer sind die physikalischen Zusammenhänge nicht ganz so klar und mir ist nicht bekannt, welchen akademischen Grad bzw. welches Grundwissen oder Ausbildung Du hast.
Wenn es keinen Sinn hat, werd ich mich natürlich bei Deinen zukünftigen Fragen zurück nehmen, um Dich nicht weiter zu verärgern.
Sollst ja auch Deine Freude am Forum haben ...
Der letzte Post hätte Dich mit Sicherheit nicht mehr Zeit gekostet, wenn Du einfach Deine Frage nochmal deutlicher formuliert hättest.
Vielleicht würde ich sie dann auch besser verstehen und wir hätten die Möglichkeit gehabt, Deine Argumente "besser zu argumentieren".
Gruß Erwin,
dem es gerade etwas sauer aufstößt und ...
Edit: Gruß eingekürzt ...
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Freitag 23. August 2024, 21:34
von MaltHopMagic
Hallo Erwin,
ich bin nicht verärgert. Ich versuche hier zu lernen und zu verstehen, und wenn ich etwas beitragen kann, auch das. Und wenn das nicht geht, breche ich lieber aktiv ab, statt das irgendwo verlaufen zu lassen.
Ich steige also gern wieder ein. Meine erste Frage steht in #14:
"... warum sollte eine lange still stehende Flasche (oder Faß) nicht im Gleichgewicht sein? Gleichgewichte stellen oft erst nach langer Zeit ein, weil das sich das System (geschlossene Flasche) dann ausgleichen kann. Zeit ist quasi die Voraussetzung für ein Gleichgewicht."
Gleichgewichte bestehen unter Bedingungen. So lange die konstant sind bleibt das System in dem Zustand.
Wir betrachten das Gleichgewicht von CO2 Gehalt und Druck. Die Bedingungen hier sind z.B. Temperatur, Bewegungszustand der Flüssigkeit (ruhend/geschüttelt). Ändere ich eine Bedingung, stellt sich das Gleichgewicht anders ein und bleibt dann unter konstanten neuen Bedingungen unverändert so. Die Flasche kann ewig ruhig stehen, der Druck wird bei 2,3bar bleiben. Ich kann die Flasche ewig gleichmäßig stark schütteln, der Druck wird sich auf einen konstanten Wert X einstellen.
Beide Drücke sind repräsentativ für ihren jeweiligen Zustand. Und reproduzierbar herstellbar. Und immer wieder in den anderen Gleichgewichtszustand überführbar.
Gehtst du da mit?
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Freitag 23. August 2024, 22:24
von RW-Brauer
Wenn es auf 20C erwärmt wird, sollte sich ein Druck von über 5 bar einstellen.
Das wäre dann zolltechnisch Sekt und unterläge entsprechend der Sektsteuer

Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Samstag 24. August 2024, 13:55
von Braufex
MaltHopMagic hat geschrieben: Freitag 23. August 2024, 21:34
Ich steige also gern wieder ein.
Also gut, neuer Einstieg

Gleichgewichte bestehen unter Bedingungen. So lange die konstant sind bleibt das System in dem Zustand.
Wir betrachten das Gleichgewicht von CO2 Gehalt und Druck. Die Bedingungen hier sind z.B. Temperatur, Bewegungszustand der Flüssigkeit (ruhend/geschüttelt). .
Gehtst du da mit?
Da gehe ich mit:
Die Flasche kann ewig ruhig stehen, der Druck wird bei 2,3bar bleiben. Ich kann die Flasche ewig gleichmäßig stark schütteln, der Druck wird sich auf einen konstanten Wert X einstellen.
Beide Drücke sind repräsentativ für ihren jeweiligen Zustand. Und reproduzierbar herstellbar.
Da gehe ich nicht mit:
Frage aus #14:
... warum sollte eine lange still stehende Flasche (oder Faß) nicht im Gleichgewicht sein? Gleichgewichte stellen oft erst nach langer Zeit ein, weil das sich das System (geschlossene Flasche) dann ausgleichen kann. Zeit ist quasi die Voraussetzung für ein Gleichgewicht."
Das Konzentrations(!)-Gleichgewicht wird durch den Druck (=Zwang) in der Flasche dahingehend beeinflusst bzw. verschoben, dass sich das CO2 zu einem höheren(!) Anteil in der Flüssigkeit anreichert und der Druck somit sinkt.
Das Prinzip des kleinsten Zwanges (Prinzip von Le Chatelier).
Somit ist bei Flaschen in der Ruhephase das Konzentrations-Gleichgewicht gestört und in Richtung Flüssigkeit verschoben.
Der Druck darf in diesem Zustand
nicht für die CO2-Bestimmung nach Tabelle verwendet werden.
Jetzt kommt der zweite Punkt:
Erst wenn ich durch Schütteln Energie in die Flasche bringe, stellt sich das Konzentrations-Gleichgewicht wieder her.
Erst jetzt kann das Henry-Dalton‘sche Gesetz, wonach bei gegebener Temperatur die Konzentration des in einer Flüssigkeit gelösten idealen Gases dem Partialdruck des Gases in der Gasphase proportional ist, angewendet werden.
Beim Schütteln sinkt der CO2-Gehalt in der Flüssigkeit und steigt in der Gasphase => der Gasdruck steigt, bis ein Gleichgewicht erreicht ist.
In diesem Gleichgewichtszustand kann und darf ich den Druck zur Bestimmung des CO2-Gehaltes verwenden.
Du hast zwar in der ruhenden Flasche irgendwann ein beruhigtes und ausgeglichenes System, ein Konzentrations-Gleichgewicht (das für das Messen nötig ist) hast Du dann aber nicht mehr.
Ich hoffe, dass ich Deine Frage jetzt richtig verstanden hab und die Erklärung für dich nachvollziehbar ist.
Wenn nicht, hilf mir ...
Wir können beide dabei lernen ...
Gruß Erwin
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Samstag 24. August 2024, 14:39
von jkb
Braufex hat geschrieben: Samstag 24. August 2024, 13:55
Beim Schütteln sinkt der CO2-Gehalt in der Flüssigkeit und steigt in der Gasphase => der Gasdruck steigt, bis ein Gleichgewicht erreicht ist.
In diesem Gleichgewichtszustand kann und darf ich den Druck zur Bestimmung des CO2-Gehaltes verwenden.
Wie stelle ich denn dann mein Spundventil richtig ein? Wenn ich es nach Tabelle mache, hab ich dann ja überkarbonisiertes Bier, weil ich im Keg keinen Gleichgewichtszustand habe. Oder schüttelst du deine Kegs?
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Samstag 24. August 2024, 16:25
von Braufex
jkb hat geschrieben: Samstag 24. August 2024, 14:39
Wie stelle ich denn dann mein Spundventil richtig ein? Wenn ich es nach Tabelle mache, hab ich dann ja überkarbonisiertes Bier, weil ich im Keg keinen Gleichgewichtszustand habe. Oder schüttelst du deine Kegs?
Ich bin erst spät hinter diese Unstimmigkeit gekommen.
Am Anfang hab ich mit 1,1 bar und 8°C gespundet, da ich auf 5 g CO2/L kommen wollte.
Da war es bei mir eher schlecht zu zapfen und ich hatte immer zu viel Schaum.
Ich habe festgestellt, dass mein Bier bei 0,9 bar (in Ruhe) und bei ca. 8°C optimal zu zapfen und zu trinken ist (Keezer => max. 10cm Höhe und kurze Schläuche mit max. 1m Länge).
Dies würde laut Tabelle einer Karbonisierung von 4,6 g CO2/L entsprechen.
Das Bier ist natürlich höher karbonisiert.
Es kommt noch dazu, dass ich ein CO2-Rückschlag-Ventil eingebaut habe.
Somit ist der Druck im Keg noch ca. 0,1 bis 0,2 bar tiefer, real ca. 0,7 - 0,8 bar.
Schütteln zur CO2-Bestimmung würde aufgrund des Rückschlagventils nicht funktionieren.
Ich will da auch gar keinen Aufwand betreiben.
Ich bin zufrieden mit dieser Lösung, auch wenn ich die genaue Karbonisierung so nicht messen kann.
Wichtig ist, dass man sich der Zusammenhänge bewusst ist und nicht krampfhaft auf einen bestimmten Druck laut Tabelle karbonisiert und dann Probleme beim Zapfen hat.
Bei der
Zwangskarbonisierung mit Schütteln oder Rollen passt das.
Beim Zwangskarbonisieren im stehenden und unbewegten Keg liegt man eher zu hoch.
Beim Grünschlauchen ins Keg mit Spundventil (meine Methode) auch.
Gruß Erwin
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Sonntag 25. August 2024, 13:01
von jkb
Vielen Dank für die Erklärung, das war mir nicht bewusst. Ich wollte beim nächsten Sud das erste Mal mit Spundventil arbeiten, da setze ich den Spunddruck dann erstmal niedriger an.
Re: Zwangskarbonisierung und Cold Crash Denkfehler?
Verfasst: Sonntag 25. August 2024, 21:22
von MaltHopMagic
Ich habe gedanklich ein Problem mit dem Konzentrationsgleichgewicht.
Im Bier haben wir CO2 in Flüssigleit gelöst, hier könnte man die Angabe in g/L als Konzentration verstehen.
Im Raum über der Flüssigkeit haben wir 100% gasförmiges CO2. Konzentration???
Das hätte nur Sinn, wenn man auch für den Kopfraum sagen kann, das dort die gleiche Menge in g/L vorhanden sind, auch wenn es reines CO2 ist. Also Xg/L gelöst im Bier und xg/L freies CO2 im Kopfraum.
Einige andere Punkte überspringe ich mal und komme zu Haffmanns Formel zurück, die #15 verlinkt ist. Ich habe es so verstanden, das ich dort mit dem gemessenen Druck nach schütteln und der Temperatur die CO2 Menge im Bier ausrechnen kann. Nehme ich dafür mal die bekannten Werte aus den Spundungstabellen 2,3bar und 20°C kommen genau die 5,4g/L heraus, die ebenso in der Spundungstabelle stehen.

- haffmann.jpg (7.93 KiB) 1404 mal betrachtet
Diese Tabellen geben nach meinem Wissen aber den still stehenden Zustand wieder. Hier sehe ich jetzt einen Widerspruch, denn wenn ich die Flasche schüttle, steigt der Druck auf mehr als 2,3bar an, und das wäre ja der eigentlich in die Formel einzusetzende Wert.
Die Konsequenz von allem wäre doch, das alle Spundungstabellen und Karbonisierungsrechner falsche, in der Praxis so nicht auftretende Zusammenhänge darstellen. Kann natürlich sein, kann ich mir jedoch nur schwer vorstellen. Bzw. müsste es zwei Tabellen geben, eine für geschütteltes und eine für ruhiges Bier.
Bei der nächsten
Zwangskarbonisierung werde ich mal mit vorher - nachher wiegen versuchen ein paar Daten zu erzeugen.
 ?
? .
.